IEC 60601-1「医用電気機器−第1部:基礎安全及び基本性能に関する一般要求事項(降、通則)」は、医用電気機器の安全を確保するための基本的な要求事項を規定しており、グローバルに医用機器を展開するメーカーにとって重要な規格です。
新たな要求事項の理解で、適合性を実現
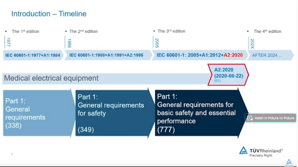
医療機器の安全性確保に関する要求がますます厳しくなる中、当規格は追補2により改訂され、第3.2版として2020年8月に正式発行されました。医療機器メーカーは、この改訂による変更点に十分注意して対応しなければならなりません。安全な製品開発を成功させるために、変更内容と規格全体を理解することが非常に重要です。
第3版 追補2(60601-1 Edition 3.2)の新たな要求事項を理解することで、製品開発の準備を整え、適合性を実現することが可能になります。十分な準備をすることが、市場投入までの時間短縮や、再試験や製品開発にかかる時間とコスト削減につながります。
テュフ ラインランド ジャパンは、改訂内容を正しく理解していただくための導入編セミナーを2021年7月に実施しました。
以下より視聴登録をしていただくと、本セミナーをご視聴いただけます。
また、7月13日(水)には「基礎編」を開催し、さらに踏み込んだ変更内容を解説します。まずは導入編をご活用ください。
📌基礎編セミナー日時:2022年 7月13日(水) 14:30~16:00
受講料◆ 11,000円(税込み)
このIEC 60601-1(通則)の改訂と並行して、以下の副通則と関連規格も改訂されました。
- IEC 60601-1-2 (EMC)
- IEC 60601-1-6(ユーザビリティ)
- IEC 60601-1-8(アラーム)
- IEC 60601-1-9(環境)
- IEC 60601-1-10(生理的閉ループ制御)
- EC 60601-1-11(在宅)
- IEC 60601-1-12(救急)
<関連規格>
- ISO 14971:2019(リスクマネジメント)
- IEC 62366-1 Amd1:2020(ユーザビリティエンジニアリング)
安全性と品質、性能を確実にし、スムーズな市場参入を目指すため、テュフ ラインランドのサービスを活用ください。
お問い合わせ:カスタマーサービス(E-Mail: info@jpn.tuv.com)
更新日 : 6/27/2022